
細胞外囊泡:在斑馬魚(yú)中捕捉希望
發(fā)布時(shí)間:
2019-08-16
前言
多種證據表明循環(huán)EV參與生理和病理環(huán)境中的細胞-細胞通訊。盡管現在他們的細胞生物學(xué)在體外得到了更好的了解,但由于缺乏適應小型EV的動(dòng)物模型,它們在復雜生物體中如何在亞細胞水平上表現仍然難以評估。斑馬魚(yú)胚胎允許循環(huán)EV從其原始細胞到其靶細胞的可視化,并允許在發(fā)育或腫瘤進(jìn)展期間進(jìn)一步探索它們的命運和功能。在未來(lái),斑馬魚(yú)系統肯定有助于擴展在整個(gè)生物體水平上的EVs知識。
細胞外囊泡(EV)在所有生物的體液中循環(huán),它們參與細胞間跨器官交流。跟蹤和理解這些納米尺寸的物體一直受到成像技術(shù)的低分辨率和缺乏適當的動(dòng)物模型的阻礙。斑馬魚(yú)胚胎的使用允許使用光學(xué)和電子顯微鏡以前所未有的時(shí)空分辨率觀(guān)察EV。這使得能夠并排研究?jì)仍葱陨鞥V和病理性EV,并進(jìn)一步揭示其在整個(gè)生物體中的生物發(fā)生,生物分布和靶細胞的機制。這些發(fā)展將有助于更好地理解EV的體內生理學(xué)。
生物發(fā)生和分泌
EV是膜囊泡的異質(zhì)集合,其富含蛋白質(zhì),遺傳物質(zhì)和脂質(zhì)的子集,反映了細胞類(lèi)型和起源細胞的生理狀態(tài)。它們來(lái)自晚期內體-通常被稱(chēng)為外泌體-或直接從質(zhì)膜(PM)發(fā)芽,在這種情況下它們被稱(chēng)為微泡。除EV家族的這兩個(gè)主要成員外,還描述了其他細胞外結構,如凋亡小體,外顯子,以及斑馬魚(yú)胚胎中涉及的migrasomes,并已在人血清中檢測到。8月7日巴黎圣安妮大學(xué)精神病學(xué)和神經(jīng)科學(xué)團隊在Trends in Cell Biology查看期刊詳情上發(fā)表了“Extracellular Vesicles: Catching the Light in Zebrafish”,本綜述主要關(guān)注外泌體和微泡。

EV最近的進(jìn)展以深入描述EV的各個(gè)亞群已經(jīng)導致建立了一個(gè)共同的命名法,以通過(guò)它們的大?。ù蠛托V)或它們的起源(外泌體與微泡)來(lái)區分EV亞群。然而,尺寸,密度和組成通常在EV亞群之間重疊。因此,仍然完全確定PM衍生的小EV與組織或功能中的內體衍生的EV的差異程度。外泌體和微泡對體內EV總量的各自貢獻同樣仍然是未解決的問(wèn)題。它們在體液中的高豐度與建議的短半衰期相結合表明體內持續分泌。盡管如此,各種報告表明EV可能以組成型和誘導型方式釋放,并且可能依賴(lài)于細胞類(lèi)型。了解EV生物發(fā)生,攝取和功能已經(jīng)從體外和體內研究中獲益。然而,EV分泌的實(shí)時(shí)可視化長(cháng)期以來(lái)是不可能的,這阻礙了細胞類(lèi)型和組織中EV生理釋放和攝取率的仔細評估。因此,對體內EV半衰期的詳細分析以及對不同EV生物發(fā)生和釋放機制的相對貢獻的仔細評估已經(jīng)落后。最近開(kāi)發(fā)的方法現在允許通過(guò)體外和體內的單細胞可視化EV釋放,即使可視化體內釋放過(guò)程本身仍然在技術(shù)上具有挑戰性。
具體地說(shuō),外泌體報告基因CD63-pHluorin的組織特異性表達揭示了發(fā)育中的斑馬魚(yú)胚胎以同線(xiàn)蛋白-a依賴(lài)性方式分泌大量外泌體。在這種情況下,斑馬魚(yú)模型增加了之前在體外描述的EV生物發(fā)生途徑的極少數體內研究。通過(guò)利用斑馬魚(yú)中的組織特異性啟動(dòng)子,可以使用類(lèi)似的方法來(lái)確定體內每個(gè)組織的外泌體和微泡的生理分泌速率和局部擴散。有趣的是,循環(huán)EV的水平隨著(zhù)生理狀態(tài)的變化或在各種病理發(fā)展期間而增加。因此,當擾亂體內平衡和/或EV間隙受到干擾時(shí),EV分泌水平可能會(huì )增加。這些假設現在可以使用已建立的斑馬魚(yú)病理模型來(lái)解決,其中已知EV發(fā)揮核心作用??傮w而言,EV釋放的體內成像將有助于在生理和病理條件下確認并進(jìn)一步探索EV分泌組織。
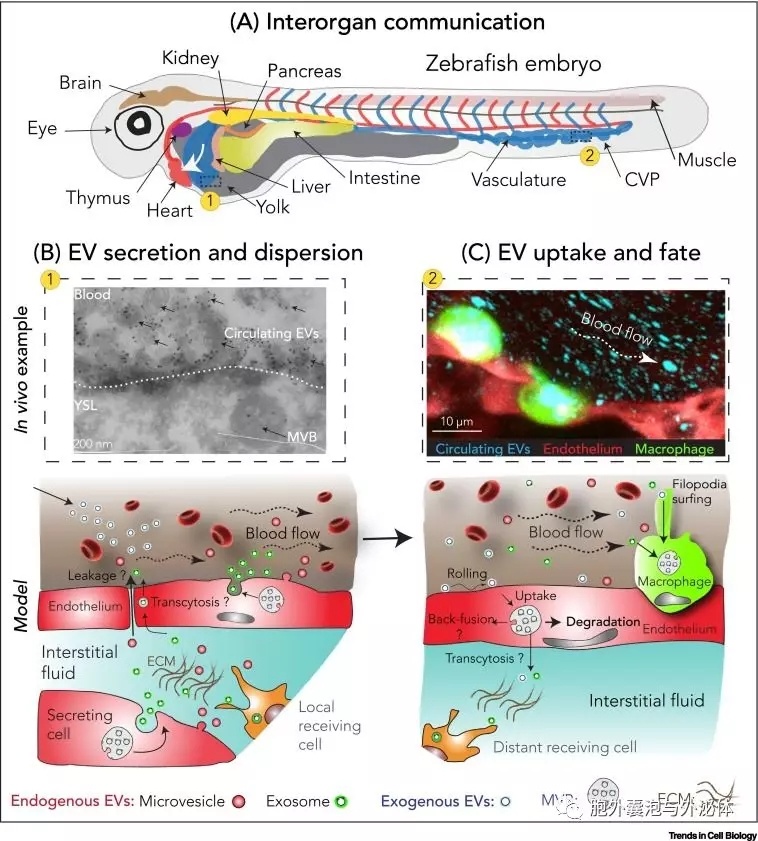
Figure 1:斑馬魚(yú),解除體內細胞外囊泡(EV)的秘密的新模型。
運輸:身體流體的傳播和行為
高時(shí)空分辨率的體內成像可以揭示EV如何在分泌細胞周?chē)鷶U散,它們如何穿過(guò)生物屏障,以及最終它們如何在通過(guò)身體傳播之前到達循環(huán)。在體內,大多數細胞不與血液直接接觸,而是與間質(zhì)液隔室構成,其占細胞外總體液體積的約75%。有趣的是,在斑馬魚(yú)胚胎的間質(zhì)液中可以發(fā)現大量的內源性YSL外泌體。因此,這個(gè)隔間可能是被忽視的EV儲存器,并且可能在體內平衡或病理學(xué)中起重要作用。它可能作為EV向血管或淋巴管的運輸途徑,最近已被證明含有大量的EV?;蛘?,EV可通過(guò)其他機制到達遠離血管的細胞。實(shí)際上,多項體內研究表明,EVs可以跨越細胞屏障,但所涉及的確切機制仍有待確定。這在已知血管異??蓾B透的癌癥中尤其相關(guān)。
在這種情況下,斑馬魚(yú)胚胎提供復雜和刻板的血管網(wǎng)絡(luò ),適用于循環(huán)中EV的行為及其遠程分散的精細解剖。血液中EV的快速成像顯示,與大血細胞相比,EV跨越血管的整個(gè)寬度。這種特殊的分布可能會(huì )影響EVs的停滯和內化,而EV的進(jìn)一步由其表面粘附分子介導。此外,發(fā)現循環(huán)EV在靜脈區域比在動(dòng)脈中更有效地停滯,這表明流動(dòng)力直接影響它們靶向特定血管區域的能力。
攝?。杭毎R別和機制
在小鼠中-檢測靈敏度有限-注入血液循環(huán)的EV積聚在少數特定器官中。此外,據報道,特定器官靶向取決于存在于腫瘤EV表面的整聯(lián)蛋白庫。需要進(jìn)一步的工作來(lái)描述EV負載的整合素如何機械地確定這種特異性。這可能是由于器官依賴(lài)性富集粘附分子,或另外-這種有機體性可以通過(guò)(i)EV注射部位,(ii)血流特征,(iii)EV逃避非特異性清除的能力或(iv)滲透性來(lái)解釋。大部分器官仍然形成的斑馬魚(yú)胚胎的大小和透明度,使得能夠實(shí)時(shí)更好地了解EV生物分布。有趣的是,體內大部分內源性釋放的外泌體以及注射到斑馬魚(yú)胚胎中的預標記腫瘤EV被尾靜脈叢吸收。CVP高度富集清道夫內皮細胞,使人聯(lián)想到哺乳動(dòng)物肝臟內的肝竇內皮細胞。此外,這個(gè)血管區域顯示出較慢的血流動(dòng)力學(xué),從而促進(jìn)EV停滯。利用斑馬魚(yú)模型系統的高時(shí)空分辨率,通過(guò)使用動(dòng)力蛋白抑制劑和體內應用的清道夫受體的競爭性抑制劑進(jìn)一步證明,這些內皮細胞的EV攝取可能是由發(fā)動(dòng)蛋白中的清道夫受體介導的。值得注意的是,參與靶細胞的受體和特異性表面EV蛋白之間的相互作用可能導致信號通路的直接激活,并可能?chē)乐赜绊戇@些EV的命運。實(shí)際上,EV的子集可以通過(guò)將信號傳遞給位于靶細胞PM的受體來(lái)發(fā)揮其主要功能。
這些研究同樣表明通過(guò)巡邏CVP血管腔中存在的巨噬細胞有效攝取EV。這種攝取可能通過(guò)絲狀背斜和巨噬細胞增多癥發(fā)生。受體表達的遺傳干擾或其體內運輸的調節可以提供對這些過(guò)程的更多洞察。最后,由于病理性EV的持續分泌水平導致的清除機制的破壞或飽和可能擴大靶細胞的范圍,從而“改變”這些EV的病理作用。在這方面,體內EV分泌水平的生理或病理水平的近似可能證明對于真正理解它們的重要性是關(guān)鍵的。因此,斑馬魚(yú)中高分辨率的實(shí)時(shí)成像可以幫助進(jìn)一步解釋EV隨時(shí)間的細胞類(lèi)型特異性靶向,以及它們在PM和所涉及的受體上的停留時(shí)間的細節。此外,它將允許詳細分析它們在體內亞細胞水平的攝取和運輸。
命運:退化,反向融合和消息傳遞
內化后,EVs遵循三種可能的命運:(i)運輸至溶酶體-導致其內容物退化/再循環(huán); (ii)EV與后內體的限制性膜的反向融合-導致EV貨物遞送至細胞質(zhì)和/或將外來(lái)體跨膜蛋白整合到宿主細胞膜中; (iii)EV的分泌?;蛘?,EVs可以與接收PM融合以運送貨物,但大多數報告表明貨物運輸前的吸收。由于目標細胞中EV的命運將直接影響其功能,因此與EM結合的實(shí)時(shí)成像可以成為進(jìn)一步破譯EV生理學(xué)這一方面的有力工具。通過(guò)使用標記有pH敏感和非pH敏感標記物組合的EV標記物與pH敏感性組合,體內成像可用于證明向晚期內體區室的運輸。有趣的是,最近使用13C標記的同位素標記的報告表明,被溶酶體降解的EV貨物可以被細胞重新利用。在斑馬魚(yú)胚胎發(fā)育的背景下,CVP的內皮細胞對YSL衍生的內源性EV的攝取和溶酶體降解顯示提供營(yíng)養支持。即便如此,通過(guò)EV的降解,向溶酶體區室的運輸可能并不僅僅與營(yíng)養支持有關(guān)。使用相關(guān)光學(xué)和CLEM證實(shí)了巡回巨噬細胞的晚期內體/溶酶體內化EV的積累。這種方法可以在斑馬魚(yú)中有效地進(jìn)行,從而解鎖與功能性貨物轉移到接收細胞有關(guān)的一些剩余秘密。盡管它們被分選到溶酶體區室,腫瘤EV確實(shí)可以誘導巨噬細胞活化,這表明EV信息/內容的轉移可能在該過(guò)程的某個(gè)步驟發(fā)生。同樣,在不久的將來(lái),通過(guò)跟蹤EV攝取和調節后接收細胞的表型變化,可以直接在斑馬魚(yú)中評估EV的功能影響,擴展到其他生物學(xué)問(wèn)題。
結論
盡管最近取得了重大進(jìn)展,但外泌體和其他體內EV的確切相關(guān)性仍然模糊不清。此外,雖然病理學(xué),特別是癌癥,被廣泛研究,但正常生理學(xué)中EV的確切功能仍然難以捉摸。解決這些問(wèn)題需要模型系統,允許高分辨率動(dòng)態(tài)觀(guān)察EV釋放,運輸和攝取,以及調整EV釋放和定位的工具。嚙齒動(dòng)物模型還沒(méi)有適應這樣的任務(wù),無(wú)脊椎動(dòng)物模型,盡管有其他優(yōu)點(diǎn),大多缺乏類(lèi)似于人類(lèi)的循環(huán)系統。相比之下,斑馬魚(yú)胚胎具有許多優(yōu)勢,包括快速發(fā)育,低成本,基因改造的適應性和自然透明度-允許非侵入性成像-和血管網(wǎng)絡(luò )。通過(guò)將高速體內顯微鏡與EM分析相結合,他們成功地允許以高時(shí)空分辨率探測單個(gè)EV。與高時(shí)空分辨率成像兼容的體內方法,現在可以在斑馬魚(yú)胚胎中使用,將有助于解開(kāi)EVs的旅程和功能的基本方面。




